工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。
Ⅰ.有机物A可视为是烃B分子中的所有氢原子被烃C分子中最简单的烃基取代而得到的。且已知:①A遇Br2的CCl4溶液不褪色,其一氯代物只有一种。②一定量的B完全燃烧,产物中n(CO2):n(H2O)=2:1,且26<M(B)<78。③烃C为饱和链烃,通常情况呈气态,其同分异构体不超过2种,其二溴代物有3种。试回答下列问题:
(1)烃B的最简式为______,分子式为______。
(2)烃C的名称为。
(3)A的分子式为________。
Ⅱ.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中分别装有浓硫酸和乙醇溶液,试管d中装有浓溴(表面覆盖少量水)。请填写下列空白: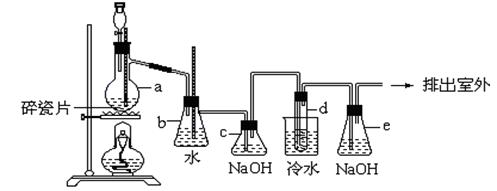
(1)请写出烧瓶a中发生的化学反应方程式:。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:。
(3)c装置内NaOH溶液的作用是;e装置内NaOH溶液的作用是。
Ⅰ.下图中A、B、C分别是三种有机物的结构模型:
请回答下列问题:
(1)A及其同系物的分子式中的碳原子数用n表示。当n=_______时,烷烃开始出现同分异构体。B模型是有机物的________模型。
(2)结构简式为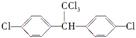 的有机物中,分子中最多有个原子共面。
的有机物中,分子中最多有个原子共面。
(3)等质量的A、B、C三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是________(填分子式)。
Ⅱ.在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是________。
A.CH3COOH B.C(CH3)4 C.CH3COOCH3D.CH3OH
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如下图所示,则A的结构简式为________。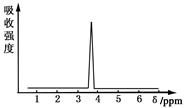
(3)用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是________________________ 。
Ⅰ.A、B、C、D、E五种有机物分子中碳原子数相同,A为气态,标准状况下的密度为1.16g·L-1;B或D跟溴化氢反应都生成C;D在浓硫酸存在下发生消去反应生成B,一定条件下被催化氧化可生成E。
(1)A、B、C的结构简式分别是________、、
(2)写出下列反应的方程式D→E___________________________________________________________。
Ⅱ.有机物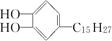 是我国特产漆的主要成分。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是mol、 mol
是我国特产漆的主要成分。能够跟1 mol该化合物起反应的Br2或H2的最大用量分别是mol、 mol
已知氮元素有许多化合价,其化合价有一3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是____________。
(2)以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,
①该电池工作时的总反应为_______________________
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。
(1)能源的开发利用与人类社会的可持续性发展息息相关。
已知:① Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1="a" kJ/mol
②CO(g)+1/2 O2(g)=CO2(g)△H2="b" kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s)△H3="c" kJ/mol
则C的燃烧热____________________________kJ.mol-1
(2)某实验小组模拟工业合成氨反应N2+3H2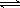 2NH3△H ="-92.4" kJ/mol,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3△H ="-92.4" kJ/mol,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
①反应达平衡的标志是(填字母代号)_____________
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为___________
③若提高N2的转化率可采取的措施有_______________
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中c(CO32-)=0.2mol/L,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol /L。