某同学利用如图装置制NO并进行相关实验探究。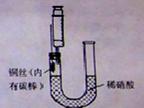
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是 ,在步骤3中可以观察到的现象为 。
(4)在铜丝上绑上石墨的作用是 。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 |
实验现象 |
实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ |
_______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
_______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下:
请回答下列问题:
(1)A的分子式为;这五种化合物中,互为同分异构体的是(填序号)。
(2)若 ,且Y是D的同分异构体,写出反应①的化学方程式:,Y的结构简式为,反应③属于反应。
,且Y是D的同分异构体,写出反应①的化学方程式:,Y的结构简式为,反应③属于反应。
某化学兴趣小组设计了下图所示实验装置,其中c为石墨电极,d为银电极。
(1)甲池中OH-移向极(填电极的字母序号),f为(填电极名称)。
(2)a极上的电极反应式是。
(3)乙池中放出气体的电极为极(填“c”或“d”),写出此电极反应式:。
(4)乙池中总反应的离子方程式是。
(5)当乙池中阴极质量增加5.40 g时,丙池某电极析出1.60 g金属,则丙池的溶液中溶质可能是(填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。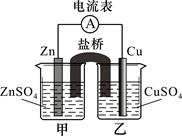
(1)Cu极为原电池的极(填“正”或“负”),电极反应式是;Zn极发生(填“氧化”或“还原”)反应。
(2)盐桥中K+移向(填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针(填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲,乙。
铁矿石是重要的金属矿物资源,我省攀西地区有丰富的钒钛磁铁矿。
(1)在自然界中,钛(Ti)、钒(V)存在多种核素,其中 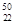 Ti与
Ti与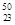 V相同的是。
V相同的是。
| A.质子数 | B.中子数 | C.质量数 | D.核外电子数 |
(2)通过下列方法可以测定磁铁矿中铁的含量:将磁铁矿溶于较浓的盐酸中,用SnCl2将Fe3+还原为Fe2+,最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+。
①磁铁矿中Fe3O4溶于盐酸时发生反应的离子方程式为。
② 配平K2Cr2O7溶液滴定FeCl2溶液时发生反应的离子方程式:
Fe2++Cr2O72-+H+==Fe3++Cr3++H2O
③现有磁铁矿样品0.500 g,经上述各步反应后,共用去0.0200 mol/L的K2Cr2O7溶液24.5 mL。计算该样品中铁的质量分数(计算结果保留1位小数)。
将11.2 L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6 g。原气体混合物中乙烯与乙烷的物质的量之比为________。