T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是 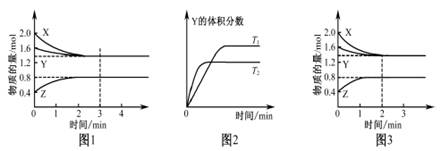
A.反应进行的前3 min内,用X表示的反应速率 |
| B.平衡时容器内的压强为反应前的0.9倍 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
下列物质转化在给定条件下能实现的是()
①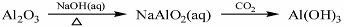
② 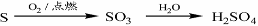
③ 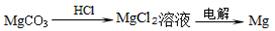
④ 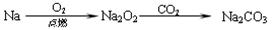
| A.①③ | B.③④ | C.②④ | D.①④ |
设NA为阿伏加德罗常数的值,下列说法正确的是()
| A.2.0gH218O与D2O的混合物中所含中子数为NA |
| B.1mol Na2O2固体中含离子总数为4 NA |
| C.标准状况下,22.4 LSO3含有NA个分子 |
| D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
下列有关能量的叙述错误的是()
| A.应用盖斯定律可以计算某些难以直接测定的反应热 |
| B.化学键的断裂和形成是化学反应中发生能量变化的主要原因 |
| C.HCl(aq)和NaOH(aq)反应的中和热为57.3kJ/mol,则CH3COOH(aq)和NaOH(aq)完全反应生成1mol H2O(l)时,放出的热量为57.3kJ |
| D.CO(g)的燃烧热是283.0 kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H="+566.0" kJ/mol |
下列物质与其用途完全符合的有()
①Na2CO3—制玻璃; ②SiO2—太阳能电池; ③Na2SiO3—木材防火剂; ④NH3—制冷剂;
⑤Al2O3—焊接钢轨; ⑥NaClO—消毒剂、漂白织物 ⑦Fe2O3—红色油漆或涂料
| A.4个 | B.5个 | C.6个 | D.7个 |
一般情况下,前者无法决定后者的是()
| A.原子核外电子排布——元素在周期表中的位置 |
| B.化合物熔融状态是否导电——化合物是否为离子化合物 |
| C.分子间作用力的大小——分子稳定性的强弱 |
| D.物质内部储存的能量高低——化学反应的热效应 |