某温度下,向一定体积0.1 mol/L的氨水中逐滴滴加0.1mol/L的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是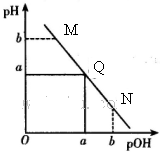
| A.M点所示溶液中c( NH4+)>c(Cl-) |
| B.Q点所示溶液的导电熊力强于M点 |
| C.Q点消耗盐酸的体积等于氨水的体积 |
| D.M点和N点所示溶液中水的电离程度相同 |
下列反应的离子方程式正确的是( )
| A.铁和稀盐酸反应2Fe+6H+=2Fe3++3H2↑ |
| B.碳酸钙溶于稀盐酸中 CO32-+2H+=CO2+H2O |
| C.碳酸氢钠溶液与盐酸反应HCO3-+H+=CO2+H2O |
| D.氧化铜与盐酸反应 O2― +2H+=H2O |
在氧化还原反应:2H2S + SO2 =" 3S" + 2H2O中,被氧化与被还原的硫原子数比是()
| A.1:1 | B.1:2 | C.3:2 | D.2:1 |
下列化学反应,不属于氧化还原反应的是()
A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
C.3Fe+2O2 Fe3O4 Fe3O4 |
D.CaCO3 CaO + CO2↑ CaO + CO2↑ |
NA表示阿伏加德罗常数,下列叙述正确的是()
| A.22.4L的N2和CO所含分子数均为NA |
| B.1.7g H2O2中含有的电子数为0.9 NA |
| C.1mol Na2SO4固体中含离子总数为4 NA |
| D.标准状况下,2.24L CCl4所含分子数为0.1 NA |
下列化学变化中,需加入氧化剂才能实现的是()
| A.C→CO2 | B.CO2→CO | C.CuO→Cu | D.H2SO4→BaSO4 |