海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下:
①“吸收装置”中发生反应的离子方程式是 .
②上述流程中循环利用的物质是 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示:
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是 ;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是 。
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁。
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是 。
②要利用MgCl2·6H2O制得尢水氯化镁.应采取的措施是 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气的冷却剂的是 (填字母)。
A.Ar B.CO2 C 空气 D.O2 E.水蒸气
Cl2及其化合物在生产、生活中具有广泛的用途。
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是__________;
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为__________________。
(2)①ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式________ ;
②工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,生成ClO3–的电极反应式为 。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号);
②B → A + D反应的热化学方程式为 (用离子符号表示)。
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
① H2O2处理法:NaCN + H2O2 — N2↑+ X + H2O
推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1B.1/2 C.2D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示: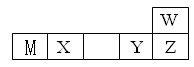
其中只有M为金属元素,请回答下列问题:
(1)M在元素周期表中的位置为 ,比较Y与Z两种元素的简单离子的半径大小 (用离子符号表示)。
(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式 。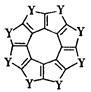
(3)科学家研制出一种新型分子C16Y8(结构如图所示)它将成为潜在的储氢材料。1molC16Y8最多能与 molH2发生加成反应。
(4)一种名贵黄石组成为M2(XO4)WOH,在强碱性溶液中会发生腐蚀,写出其过量NaOH溶液反应的化学方程式 。
Ⅰ以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下: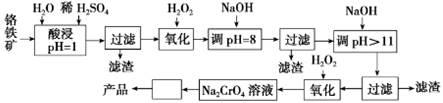
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO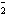 形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
7.6 |
9.0 |
—— |
—— |
| 沉淀完全时的pH |
3.7 |
9.6 |
11.0 |
8 |
9(>9溶解) |
(1)写出流程中第2次使用H2O2时,发生反应的离子方程式 。
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么? 。
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是 。
(4)CrO42-在酸性条件下转化为Cr2O72-。工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为 ,再调节溶液的pH= ,使金属离子生成沉淀而除去。
Ⅱ(1)已知:20°C时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3•H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂.可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式 .
硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物。一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如下: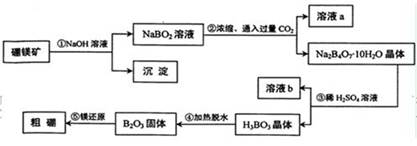
结合流程图回答下列问题:
(1)溶液a、溶液b中溶质的化学式分别为 、 。
(2)写出步骤①的化学方程式 。
(3)写出步骤②的离子方程式 。
(4)步骤③中化学反应可以发生的原因是 。
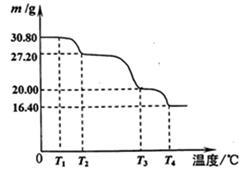
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。 实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。