铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下: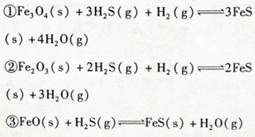
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是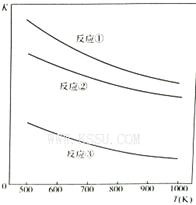
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
反应2A(g) 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()
2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()
| A.加压 | B.减压 | C.减少E的浓度 | D.降温 |
下列说法不正确的是()
| A.体系有序性越高,熵值就越低 | B.自发过程将导致体系的熵增大 |
| C.吸热反应一定不可以自发进行 | D.同种物质气态时熵值最大 |
下列反应属于吸热反应的是 ()
A.C6H12O6(葡萄糖aq)+6O2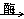 6CO2+6H2O 6CO2+6H2O |
| B.CH3COOH+KOH=CH3COOK+H2O |
| C.A+B=C+D;ΔH <0 |
| D.反应物的键能大于生成物的键能 |
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是()
| A.反应进行的方向 | B.反应的快慢 |
| C.反应进行的限度 | D.反应物的多少 |
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为
| A.1:2:3 | B.1:6:9 | C.1:3:3 | D.1:3:6 |