氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1 ClO+O=Cl+O2ΔH2
该反应的能量变化如图示意,下列叙述中正确的是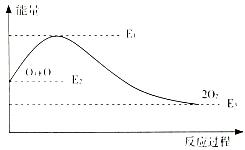
| A.反应O3+ O=2O2的ΔH=E1-E2 |
| B.反应O3+ O=2O2的ΔH=E2-E3 |
| C.反应O3+ O= 2O2是吸热反应 |
| D.反应O3+ O=2O2的ΔH=ΔH1+ΔH2 |
下列关于化学学习和研究的说法错误的是()
| A.化学模型有助于解释一些化学现象 | B.质量守恒定律是大量实验事实的总结 |
| C.化学家提出的假设都能被实验证实 | D.化学基本原理的应用是有一定条件的 |
日常生活中常用下列方法处理相关问题,其中不涉及化学变化的是()
| A.用明矾净化河水 | B.蜂蚁螫咬处涂抹稀氨水以消除疼痛 |
| C.用食醋蒸熏对房间消毒杀菌 | D.硫酸钡作X光透视肠胃的药剂 |
已知胆矾溶于水时,溶液温度降低.在室温下将1 mol无水硫酸铜制成溶液时,放出热量为Q1 kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)===CuSO4(s)+5H2O(l);
ΔH=+Q2 kJ/mol,则Q1与Q2的关系是( )
| A.Q1<Q2 | B.Q1>Q2 | C.Q1=Q2 | D.无法确定 |
根据热化学方程式S(l)+O2(g)===SO2(g);ΔH=-293.23 kJ/mol.分析下列说法中正确的是()
| A.S(s)+O2(g)===SO2(g),反应放出的热量大于293.23 kJ/mol |
| B.S(g)+O2(g)===SO2(g),反应放出的热量小于293.23 kJ/mol |
C.1 mol  S S O2的键能的总和大于1 mol 硫和1 mol 氧气的键能之和 O2的键能的总和大于1 mol 硫和1 mol 氧气的键能之和 |
| D.1 mol SO2的键能的总和小于1 mol 硫和1 mol 氧气的键能之和 |
在某澄清、透明的浅黄色溶液中,可能含 有下列八种离子:H+、NH、Fe3+、Ba
有下列八种离子:H+、NH、Fe3+、Ba 2+、Al3+、SO、HCO、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有()
2+、Al3+、SO、HCO、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有()
| A.4种 | B.5种 | C.6种 | D.7种 |