(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①第ⅡA族元素的价电子数________。
②第三周期元素的最高正价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为_______________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________,B的化学式为________。
③工业上制取单质M的化学方程式为____________________________。
( 10分)有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是。
此液体具有的性质是(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物。若有1.5×6.02×1023个电子转移时,该反应的化学方程式是。
( 10分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。已知:CO(g) + H2O(g) H2(g) + CO2(g) △H= a kJ·mol-1的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
(1)上述正反应方向是反应(填“放热”或“吸热”)。
t1℃时物质浓度(mol/L)的变化
| 时间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量(填增大、减小或不变)。
②表中3 min~4 min之间反应处于状态;CO的体积分数16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为。
( 8分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
|

 2Fe2O3+8SO2)
2Fe2O3+8SO2)
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为。
(3)实验室制取气体B的化学方程式为。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30 min”,立即进行步骤3,则测定的结果可能
(选填“偏大”、“偏小”、“无影响”);
②上述步骤3中滴定终点的现象是。
③根据上述步骤可计算出原ClO2溶液的浓度为g / L(用含字母的代数式表示)。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为,
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为。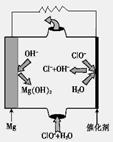
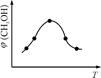
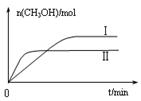
图1图2图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g)△H
CH3OH(g) +H2O(g)△H
①该反应的平衡常数表达式为K=。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH(填“>” “<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为。