随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
| A.提高尾气净化效率的最佳途径是研制高效催化剂 |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
按下图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示(忽略溶液体积的变化)
| A.c(Ag+) | B.c(NO3−) | C.Ag棒的质量 | D.溶液的质量 |
某有机物A的结构为Br—CH2—CH=CH—CH2OH,它不可能发生的反应是
| A.与硝酸银溶液反应生成溴化银沉淀 |
| B.使溴的四氯化碳溶液褪色 |
| C.与金属钠反应放出氢气 |
| D.使高锰酸钾溶液褪色 |
能说明苯分子中碳碳键不是单、双键交替的事实是
①苯不能使KMnO4溶液褪色;
②苯环中碳碳键的键长均相等;
③邻二氯苯只有一种;
④在一定条件下苯与H2发生加成反应生成环己烷。
| A.①②③④ | B.①②③ | C.②③④ | D.①②④ |
某烷烃与氯气反应只能生成一种一氯取代物,该烃的结构简式是
A. |
B.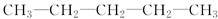 |
C. |
D. |
下列性质的比较中,正确的是
| A.氧化性:S > Cl2 | B.金属性:K>Na |
| C.酸性:H2CO3>H2SO4 | D.热稳定性:NaHCO3>Na2CO3 |