某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度下列操作会导致实验结果偏高的是
| A.滴加盐酸的过程中,未充分振荡,刚看到溶液变色,立刻停止滴定 |
| B.读取盐酸体积时,滴定前仰视,滴定后俯视 |
| C.盛标准盐酸的滴定管,滴定前无气泡,滴定后出现气泡 |
| D.若滴定前用蒸馏水洗涤锥形瓶和酸式滴定管后,均未经润洗就进行滴定 |
下列叙述中,正确的是
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 |
| C.向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 |
| D.向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
下列各组离子一定能大量共存的是
| A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B.pH试纸呈红色的溶液中:Fe2+、K+、NO3-、Na+ |
| C.水电离出的c(H+)=1×10-14mol·L-1的溶液中:Na+、Al3+、Cl-、SO42- |
| D.CO32-可以大量共存的溶液中:Ag+、K+、NO3-、Cl- |
A(g)+B(g) 2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是
2C(g)反应在密闭容器中进行,若保持容积不变,在温度分别为T1和T2时,达到平衡,B的体积分数与时间的关系如图所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是
| A.T1>T2,该反应生成物的总能量高于反应物的总能量 |
| B.该反应在高温时才能自发进行 |
| C.由平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化 |
| D.反应从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减少 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列推断不正确的是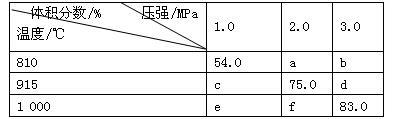
| A.该反应的△S>0 |
| B.915 ℃,2.0 MPa时E的转化率为60% |
| C.b>f |
| D.K(1000℃)>K(810℃) |