常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;
③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是( )
| A.②中由水电离出的c(H+)=1×10-12 mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
某不纯的烧碱样品,含N a2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%。取m g样品溶于40 mL 2 mol·L-1的盐酸后,并用 2 mol·L-1 NaOH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为
a2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%。取m g样品溶于40 mL 2 mol·L-1的盐酸后,并用 2 mol·L-1 NaOH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为
| A.4.68 g | B.5.58 g | C.2.34 g | D.2.34 mg |
下列说法正确的是
①标况下,6.02×1023个分子所占的体积约是22.4 L②0.5 mol H2所占体积为11.2 L③标况下,1 mol H2O的体积为22.4 L④标况下,28 g CO与N2的混合气体的体积约为22.4 L⑤各种气体的气体摩尔体积都约为22.4 L·mol-1⑥标准状况下,体积相同的气体的分子数相同
| A.①③⑤ | B.④⑥ | C.③④⑥ | D.①④⑥ |
某结晶水合物的化学式为A·xH2O,其相对分子质量为B。在60ºC时,mg该晶体溶于ng水中,制得VmL密度为dg·mL-1的饱和溶液。下列表示式或判断正确的是
A.该溶液的物质的量浓度为
B.该温度下A的溶解度为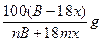
C.将10gA投入到饱和溶液中,析出的晶体大于10g,且溶液质量减少,但浓度不变
D.该溶液的质量分数为
下列离子方程式正确的是
| A.碳酸氢镁溶液和过量的NaOH溶液反应:Mg2++2OH-=Mg(OH)2↓ |
| B.二氧化硫气体通入过量的Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.Ba(OH)2溶液中滴入NaHSO4至pH等于7:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
D.KHS的水解HS-+H2O 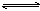 H2S+OH- H2S+OH- |
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是:①碳酸钠溶液与盐酸②偏铝酸钠溶液与盐酸③苯酚钠溶液与CO2④硝酸银溶液与氨水⑤氯化铝溶液与氨水⑥碳酸氢钠溶液与澄清的石灰水
| A.③⑤ | B.①③⑥ | C.仅有⑤ | D.②④ |