弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
已知H2A在水中存在以下平衡:H2A=H++HA-,HA- H++A2-。
H++A2-。
(1)常温下NaHA溶液的pH________(填序号,下同),原因是_____________。
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是________。
A.c(H+)·c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有________。
A.升高温度 B.降低温度
C.加入NH4Cl晶体 D.加入Na2A固体
(9)为了将混有硫酸钠的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:
(1)操作①能否用硝酸钡溶液?_____ (能或否)说明理由__________________。
(2)进行操作①后,如何判断SO42-已除尽,方法是_____________ ________________。
(3)操作②的目的是_______________,为什么不先过滤而后加碳酸钠溶液,其理由 是______________。
(10分) 下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。



AB CD
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3_____________ ;
⑵.从碘水中提取碘 _____________
⑶.用自来水制取蒸馏水_____________
⑷.分离植物油和水_____________
⑸.除去粗盐中的泥沙_____________
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下: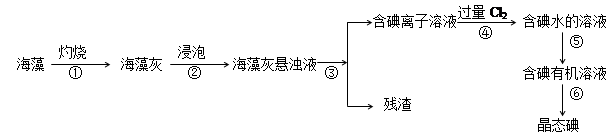
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③,步骤⑤。
(2)写出步骤④对应反应的离子方程式:。
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用(填代号)。
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是。
一定温度下在某定容容器中发生反应:2A(g) +3B(g) ===2C(g),开始时,A的浓度为
3 mol·L -1,B的浓度是5 mol·L-1,2 min后,B的浓度减少1.2 mol·L-1,则
(1)v(C) =。(2)在2min末,B的浓度是____________。
分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题: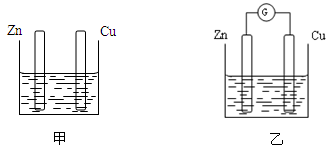
(1)以下叙述中,正确的是。
| A.甲中锌片是负极,乙中铜片是正极 | B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速率甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为,乙为。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了少量气体,分析其原因可能是。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:。