下列有关物质的性质与应用不相对应的是( )。
| A.SO2具有氧化性,可用于漂白纸浆 |
| B.常温下,铝能被浓硝酸钝化,可用铝槽车运输浓硝酸 |
| C.K2FeO4具有强氧化性,可用于自来水的杀菌消毒 |
| D.Zn具有还原性和导电性,可用做锌锰干电池的负极材料 |
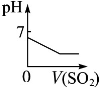
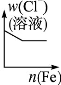
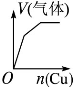
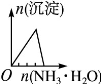
根据下列反应所画图象错误的是
| A |
B |
C |
D |
| 将二氧化硫通入 到一定量氯水中 |
将铁粉加入到一 定量氯化铁溶液中 |
将铜粉加入到 一定量浓硝酸中 |
将氨水滴入到一定 量氯化铝溶液中 |
 |
 |
 |
 |
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2==2H2O,正极反应为O2+2CO2+4e-==2CO32—,则下列推断正确的是
| A.负极反应为H2+2OH--2e-==2H2O |
| B.放电时负极有CO2生成 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
下列涉及的有机物及有机反应类型正确的是
| A.乙烯分子与苯分子中的碳碳键不同,但二者都能发生加成反应 |
| B.除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 |
| C.苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 |
| D.乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
在标准状况下,10mL某气态烃在80mL O2中充分燃烧后,恢复到标准状况,所得气体的体积为60mL,该烃可能是
| A.C3H8 | B.C3H6 | C.C3H4 | D.C4H10 |
下列说法中不正确的是
| A.食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别 |
| C.乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同 |
| D.生活中食用的食醋、植物油、动物蛋白等都是混合物 |