部分中学化学常见元素原子结构及性质如表所示:
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② |
B |
B原子最外层电子数是内层电子总数的 |
| ③ |
C |
C是常见化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ |
F |
F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是_______________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱__________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_______________________________________________________________。
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式,C的含氧官能团名称为。
(2)1molB与溴水充分反应,需消耗mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式。
写出C在强氧化剂条件下生成的有机化合物的结构简式。
(5)写出A和B在一定条件下反应,生成高分子化合物的化学方程式:
。
按要求写出下列反应的化学方程式:
(1)在苯酚钠中通入少量的CO2:
(2)HCHO与足量的银氨溶液反应:
(3)CH3CH(OH)CH2OH与氧气的催化氧化:
(4)HOOC-COOH与乙二醇反应生成环酯:
将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进行蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:
| 组别 |
1 |
2 |
3 |
| 盐酸体积(mL) |
50 |
50 |
50 |
| A的质量(g) |
3.80 |
5.70 |
7.60 |
| 气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为mol·L-1
氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值
为;t min内用NH3表示的速率是
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)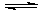 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为KJ/mol
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下转化关系:(部分反应物、产物及反应条件已略去)。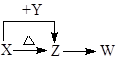
请回答下列问题:
(1)X与Y在水溶液中反应的离子方程式为;
(2)W的结构式为
(3)将Z装入圆底烧瓶,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅱ中的物质由短周期元素组成,装置Ⅲ中产生白色沉淀,装置Ⅴ 中可收集到一种能使带火星木条复燃的气体。装置Ⅱ中物质的化学键类型为 ;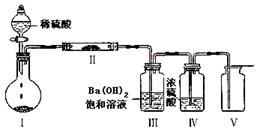
(4)下列关于X、Z的鉴别方法不正确的是
| A.分别加热X、Z的粉末,将产生的气体通入澄清石灰水,观察现象 |
| B.分别将X、Z配成稀溶液,逐滴滴加稀盐酸,观察现象 |
| C.分别将X、Z配成稀溶液,分别加入氯化钙溶液,观察现象 |
| D.分别将X、Z配成稀溶液,分别加入澄清石灰水,观察现象 |