下图是N2与H2反应生成NH3的过程中能量变化的曲线图: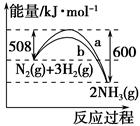
下列叙述正确的是( )。
| A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/LNaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是
| A.200mL | B.250ml | C.425mL | D.560mL |
甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
| A.5.4g | B.3.6g | C.2.7g | D.1.6g |
在1.00L 1mol/L氢氧化钠溶液中通入16.8L标准状况下的CO2气体,所得的溶液中含有的溶质是
| A.Na2CO3 | B.NaHCO3 |
| C.Na2CO3和NaHCO3 | D.NaOH、Na2CO3和NaHCO3 |
在常温下发生下列反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,判断下列结论错误的是
| A.溶液中可发生:Z2+2A2+===2A3++2Z- |
| B.Z2在①③反应中为还原剂 |
| C.氧化性强弱的顺序为:XO4->Z2>B2>A3+ |
| D.X2+是XO4-的还原产物 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是
| A.H2O2+H2SO4===SO2↑+O2↑+2H2O |
| B.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+ |
| C.SO2+I2+2H2O===H2SO4+2HI |
| D.2Fe3++2I-===2Fe2++I2 |