下列实验误差分析正确的是( )。
| A.用湿润的pH试纸测稀酸溶液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度偏高 |
反应3X(g)+Y(g)  2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为( )
| A.v(X)=0.05mol·L–1·min–1 | B.v(Z)=0.10mol·L–1·min–1 |
| C.v(Y)=0.10mol·L–1·min–1 | D.v(W)=0.05mol·L–1·min–1 |
已知空气-锌电池的电极反应为:锌片:Zn+2OH--2e-=ZnO+H2O
石墨:O2 + 2H2O + 4e-=4OH- 根据此判断,锌片是:( )
| A.负极,并被还原 | B.负极,并被氧化 |
| C.正极,并被氧化 | D.正极,并被还原 |
下列各组物质的晶体中,化学键类型相同、晶体类型都相同的是( )
| A.CO2和SiO2 | B.C60和C(金刚石) | C.NaCl和HCl | D.CO2和H2O |
下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
下列有关化学用语表示正确的是( )
A.四氯化碳分子比例模型: |
| B.次氯酸的结构式为 H-Cl-O |
C.COS的电子式是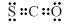 |
D.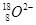 离子结构示意图: 离子结构示意图: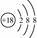 |