已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0;则下列叙述不正确的是( )
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
下列离子方程式正确的是
| A.NaHSO3溶液与NaOH溶液反应:H++OH-===H2O |
| B.少量二氧化碳通入足量的NaOH溶液:CO2+OH-===HCO |
| C.Fe与盐酸反应产生H2:2Fe+6H+===2Fe3++3H2↑ |
| D.氨水和醋酸溶液混合:NH3·H2O+CH3COOH===NH+CH3COO-+H2O |
用NA表示阿伏加德罗常数,下列说法中正确的是
| A.1mol甲烷的质量与甲烷的摩尔质量相等 | |
| B.28g氮气与40g氩气所含的原子数目相等,都是NA个 | |
C.2.3g钠由原子变成离子,失去的电子数为0.1NA |
D.18g重水(D2O)所含的电子数为10NA |
下图所示的装置最适宜于干燥、收集的气体是
| A.NO2 | B.HCl | C.CH4 | D.NH3 |
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径A>B>C>D |
| B.原子序数a>b>c>d |
| C.离子半径C3->D->B+>A2+ |
| D.单质的还原性A>B>D>C |
下列微粒的电子式书写正确的是
A.甲基   |
B.二氧化碳  |
C.三氯化磷 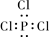 |
D.氢氧根  |