下列离子方程式书写正确的是( )
| A.将铜屑加入Fe3+溶液中:Fe3++Cu=Fe2++Cu2+ |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| C.稀硝酸和过量的铁屑反应: Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=I2+2H2O |
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法中错误的是 ( )。
| A.负极的电极反应式为CO+O2--2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a向电极b移动 |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
| A.该过程吸收的热量为86.7 kJ |
| B.此过程中需要标准状况下CH4气体1.12 L |
| C.转移的电子数为0.8NA |
| D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1 |
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,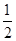 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=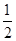 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
| A.上述热化学方程式中的化学计量数表示分子个数 |
| B.ΔH1>ΔH2 |
| C.ΔH2=-57.3 kJ·mol-1 |
| D.|ΔH1|>|ΔH2| |
下列反应中符合下图图像的是 ( )。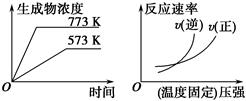
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) |
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )。
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |