一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。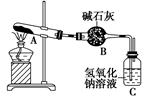
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.5 g |
140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
用NA代表阿伏加德罗常数的值,下列叙述正确的是
| A.11.2LCO和N2混合气体中含有的分子数是0.5NA |
| B.在氯气参与的反应中,22.4L(标况)氯气完全反应得到的电子数一定为0.2NA |
| C.1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
D.l L l mol·L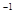 的NaClO溶液中含有ClO 的NaClO溶液中含有ClO 的数目小于NA 的数目小于NA |
下列叙述正确的是
| A.金属氧化物不一定是碱性氧化物 |
| B.HC1、H2S、NH3都是电解质 |
| C.强酸强碱都是离子化合物 |
| D.FeBr3、FeCl2、CuS都不能直接用化合反应制备 |
下列说法中错误的是
| A.少量液溴可用水封存,减少溴挥发 |
| B.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放 |
| C.实验室可以用浓氨水和生石灰制备NH3 |
| D.实验室中用加热方法分离碘和食盐的混合物 |
下列有关物质的性质和该性质的描述均正确的是
| A.Na2O2是碱性氧化物,只含离子键,能与CO2、H2O反应作供氧剂 |
| B.浓硫酸具有强氧化性,常温下可用铝罐盛装 |
| C.SO2与Cl2均具有漂白性,两者混合使用可以增强漂白效果 |
| D.硝酸具有酸性,可用硝酸与活泼金属反应制备氢气 |
化学与生活、社会密切相关。下列说法错误的是
| A.二氧化氮能使织物褪色,对金属材料也有腐蚀作用 |
| B.亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 |
| C.漂白粉在空气中能稳定存在,可用于漂白纸张 |
| D.大量燃烧化石燃料是造成雾霾天气的重要原因 |