可以用来检验碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )
| A.加热,看有无气体放出 |
| B.滴加盐酸,看有无气体放出 |
| C.溶于水后,滴加稀的氯化钡溶液看有无白色沉淀生成 |
| D.溶于水后,滴加澄清石灰水看有无白色沉淀生成 |
已知反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1和2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1。则下列说法不正确的是
| A.CO转化为CO2的热化学方程式为2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ·mol-1 |
B.CO燃烧热的热化学方程式为CO(g)+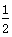 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 |
| C.放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行 |
| D.1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ |
已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是
| A.NaX NaY NaZ | B.NaX NaZ NaY |
| C.NaY NaZ NaX | D.NaZ NaY NaX |
下列叙述中不正确的是
| A.将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3 |
| B.溶液中c(H+)>c(OH—),该溶液一定显酸性 |
| C.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极 |
| D.外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池 |
某温度下,Kw=10—13,已知该温度下某浓度Na2CO3溶液的pH=10,则该溶液中由水电离的c(OH—)是
| A.1×10—10 mol/L | B.1×10—3 mol/L |
| C.1×10—4 mol/L | D.1×10—7 mol/L |
对已经达到平衡的反应 2X(g) + Y(g)  2Z(g) ΔH<0 ,下列说法正确的是
2Z(g) ΔH<0 ,下列说法正确的是
| A.缩小容器体积,正、逆反应速率都增大,平衡向逆反应方向移动 |
| B.升高反应温度,该反应的平衡常数增大 |
| C.加入催化剂,可以降低反应所需的活化能,但不改变反应的ΔH |
| D.改变条件使平衡正向移动,反应物的转化率一定都增大 |