用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应,下列有关说法不合理的是( )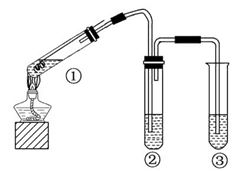
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:
CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
| A.既不是氧化剂也不是还原剂 |
| B.是氧化剂 |
| C.是还原剂 |
| D.既是氧化剂又是还原剂 |
已知M2O7x一+3S2一+14H+ 2M3++3S↓+7H2O,则M2O7x一中的M的化合价为
2M3++3S↓+7H2O,则M2O7x一中的M的化合价为
| A.+2 | B.+3 | C.+4 | D.+6 |
在Al2(SO4)3、MgSO4、K2SO4的混合溶液中,含有的Al3+ 、Mg2+ 、SO42−的个数比是2∶3∶8,则溶液中Al2(SO4)3、MgSO4、K2SO4的物质的量之比是
| A.1∶2∶4 | B.2∶3∶2 | C.1∶2∶3 | D.1∶3∶2 |
根据离子方程式:(1)2Fe3++2I- 2Fe2++I2,(2)Br2+2Fe2+
2Fe2++I2,(2)Br2+2Fe2+ 2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
下列反应的离子方程式正确的是
A.NaHCO3溶液与盐酸:CO32−+ 2H+ H2O + CO2↑ H2O + CO2↑ |
B.Ca(HCO3)2溶液与过量NaOH溶液:Ca2+ + HCO3−+ OH− H2O + CaCO3↓ H2O + CaCO3↓ |
C.用醋酸溶液除水垢:2CH3COOH + CaCO3 Ca2+ + 2CH3COO−+ H2O + CO2↑ Ca2+ + 2CH3COO−+ H2O + CO2↑ |
| D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性: |
H+ + SO42−+ Ba2+ + OH− H2O + BaSO4↓
H2O + BaSO4↓