用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是( )
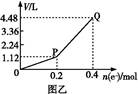
| A.电解过程中,a电极表面先有红色物质析出,后有气泡产生 |
B.b电极上发生的反应方程式为:4OH--4e- 2H2O+O2↑ 2H2O+O2↑ |
| C.曲线0~P段表示O2的体积变化 |
| D.从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol |
下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是()
| A.石灰石 | B.Ca(OH)2 |
| C.CaCO3 | D.CH4 |
下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是()
| A.实验剩余的药品不能放回原试剂瓶 | B.可燃性气体的验纯 |
| C.气体实验装置在实验前进行气密性检查 | D.滴管不能交叉使用 |
V mL硫酸铝溶液中含有mgSO42-,则Al3+的物质的量浓度为()
| A.m/ (48×3) mol/L | B.m/96 V mol/L | C.m/0.144 V mol/L | D.m/0.96 V mol/L |
对相同状况下的 和
和 两种气体,下列说法中不正确的是()
两种气体,下列说法中不正确的是()
| A.若质量相等,则分子数相等 | B.若原子数相等,则分子数相等 |
| C.若分子数相等,则体积相等 | D.若体积相等,则原子数相等 |
下列说法正确的是()
A. 的摩尔质量为32g 的摩尔质量为32g |
B.22.4L 和 和 的混合气体所含分子数为 的混合气体所含分子数为 |
C.0.1mol 和 和 的混合气体在标准状况下的体积为2.24L 的混合气体在标准状况下的体积为2.24L |
D.若1 mol 所占体积为22.4L,则其所处状况一定为标准状况 所占体积为22.4L,则其所处状况一定为标准状况 |