已知:
①I2(g)+H2(g) 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.I2(g)=I2(s) ΔH=-17.00 kJ/mol |
| C.固态碘的稳定性比气态碘的稳定性高 |
| D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多 |
根据元素周期表和元素周期律,下列推断中错误的是()
A.砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸 |
B.在周期表中金属和非金属元素的分界线附近可以寻找制取新农药的元素 |
C.镭(第ⅡA族)的硫酸盐难溶解于水,其氢氧化物是强碱 |
D.溴化氢没有氯化氢稳定,其水溶液的还原性是盐酸弱于氢溴酸 |
下列排列顺序正确的 是()
是()
①热稳定性:H2O>HF>H2S②离子半径: F->Na+>Mg2+>Al3+ ③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-
| A.①③ | B.①④ |
C.②④ | D.②③ |
对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是()
A、v(B2)="4.8" mol/ (L·min) B、v(A2)="1.5" mol/ (L·s)
C、v(C)="1.6" mol/ (L·s) D、v(B2)="1.7" mol/ (L·s)
D、v(B2)="1.7" mol/ (L·s)
已知反应 X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是()
X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是()
| A.X的能量一定低于M的能量,Y的能量一定低于N的能量 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
C.破坏反应物 中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 中的化学键所吸收的能量大于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定高于M和N的总能量 |
下列化学用语的书写,正确的是 ()
()
A.氮气的电子式: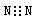 |
B.硫原子的结构示意图: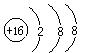 |
C.溴化钠的电子式: 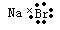 |
D.质量数为37的氯原子37 17Cl |