常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
c(HA)/mol·L-1 |
c(NaOH)/mol·L-1 |
混合后溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
b |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH<7 |
| 丁 |
0.1 |
0.1 |
pH=c |
下列对混合后溶液的有关说法中,不正确的是( )
A.甲中:若a=7,则HA是强酸
B.乙中:若b≠0.2,则c(A-)≠c(Na+)
C.丙中:若HA是弱酸,则c(A-)>c(Na+)>c(H+)>c(OH-)
D.丁中:若c=9,则c(OH-)-c(HA)=10-9 mol·L-1
分析下表中各项的排布规律,按此规律排布第26项应为
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
| C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
| A.5种 | B.6种 | C.7种 | D.8种 |
分子式为C10H14的单取代芳烃,其可能的结构有
| A.2种 | B.3种 | C.4种 | D.5种 |
下列说法不正确的是
| A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学 |
| B.蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C.通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃. |
下列说法正确的是
A.按系统命名法,化合物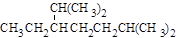 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 |
| B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 |
C.化合物 是苯的同系物 是苯的同系物 |
| D.三硝酸甘油酯的分子式为C3H5N3O9 |