下列实验现象与对应结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
常温下将Cu片放入浓H2SO4中 |
生成刺激性气味气体 |
Cu与浓H2SO4反应生成SO2 |
| B |
Al2(SO4)3溶液中滴加过量氨水 |
生成白色胶状物质 |
Al(OH)3不溶于氨水 |
| C |
向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 |
溶液先不显红色,加入氯水后变红色 |
该溶液中含有Fe2+ |
| D |
向某溶液中加入CCl4,振荡后静置 |
液体分层,下层呈紫红色 |
该溶液中存在I- |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示的变化规律 (图中P表示压强,T表示温度,n表示物质的量,a表示物质的平衡转化率).根据以上规律判断,下列结论中正确的是()
| A.反应Ⅰ:△H>0,p2>p1 | B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅰ:△H<0,p2>p1 | D.反应Ⅱ:△H>0,T2>T1 |
下列表述中正确的是 ( )
| A.NH4C1溶液因水解而显酸性,故NH4C1是弱电解质 |
B.纯碱溶液因水解而显碱性,水解的离子方程式为:CO32—+H2O H2CO3+2OH— H2CO3+2OH— |
C.可乐因含碳酸而显酸性,电离方程式为:H2CO3 CO32—+2H+ CO32—+2H+ |
| D.配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度 |
下列方法能使电离平衡H2O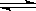 H++OH—向右移动,且使溶液呈酸性的是 ( )
H++OH—向右移动,且使溶液呈酸性的是 ( )
| A.向水中加入少量硫酸氢钠固体 | B.向水中加入少量硫酸铝固体 |
| C.向水中加入少量碳酸钠固体 | D.将水加热到100℃,使水的PH=6 |
已知下列热化学方程式:
①CH3COOH(1)+202(g)=2CO2(g)+2H2O(1)△H1=" —870.3" kJ·mol—1
②C(s)+O2(g)=CO2(g)△H2=" —393.5" kJ·mol—1
③H2(g)+1/2O2(g)=H2O(1)△H3=" —285.8" kJ·mol—1
则反应④2C(s)+2H2(g)+O2(g)=CH3COOH(1)的焓变为()
| A.+488.3 kJ·mol—1 | B.—224.15 kJ·mol—1 |
| C.—488.3 kJ·mol—1 | D.+244.15 kJ·mol—1 |
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是
| A.当溶液中c(CH3COO─)=c(Na+)时,醋酸与氢氧化钠恰好完全反应 |
| B.当溶液中c(CH3COO─)=c(Na+)时,一定是氢氧化钠过量 |
| C.当溶液中c(CH3COO─)=c(Na+)>c(H+)=c(OH─)时,一定是醋酸过量 |
| D.当溶液中c(Na+)>c(CH3COO─)>c(OH─)>c(H+)时,一定是氢氧化钠过量 |