一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 (填“增大”、“减小”或“不变”)。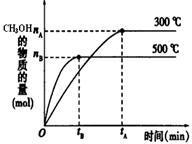
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少
b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加
d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
现有下列四种物质:①乙烯、②乙酸、③淀粉、④蛋白质。其中,能使紫色石蕊试液变红的是(填序号,下同);能使溴的四氯化碳溶液褪色的是;遇碘溶液显蓝色的是;遇浓硝酸变黄色的是。
铜跟浓硝酸可发生反应:
Cu + 4HNO3(浓) ="" Cu(NO3)2 + 2NO2 +2H2O
在该反应中,铜元素的化合价(填“升高”或“降低”),被(填“氧化”或“还原”,下同);Cu作剂若反应中生成了1 mol Cu(NO3)2,则消耗了mol Cu。
在25℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,其中O2占L,则原CO和H2的混合气体中V(CO)= L,
L,
V(H2)=L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO):V(H2) =。
(3)若剩余气体的体积为a L,则a的取值范围是。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式: □C+□+□H2SO4
□C+□+□H2SO4 □+□+□Cr2(SO4)3+□H2O
□+□+□Cr2(SO4)3+□H2O
(2)上述反应中氧化剂是(填化学式),被氧化的元素是(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为。
“绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为:KCN+H2O2+H2O A+NH3↑
A+NH3↑
回答下列问题:
(1)生成物A的化学式为。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为 .。
(3)H2O2被称为“绿色试剂”的理由是。