下列离子方程式书写正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+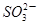 |
| C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
碳与适量水蒸气反应生成CO和H2,若有1gC参与反应,需吸收10.94KJ热量,此反应的热化学方程式为()
| A.C + H2O ==CO + H2 ; ΔH==+131.3KJ·mol—1 |
| B.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+10.94KJ·mol—1 |
| C.C(s)+ H2O(l) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 |
| D.C(s)+ H2O(g) ==CO(g) + H2(g) ; ΔH==+131.3KJ·mol—1 |
下图表示可逆反应mA(g)+nB(g) pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是 ()
pC(g)在不同温度(T)、压强(P)下,生成物C的质量分数C%的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是 ()
A.吸热反应,m+n<p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.放热反应,m+n>p
下列说法正确的是()
| A.镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 |
| B.埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀 |
| C.钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-2e-= Fe2+ |
| D.在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀 |
实验室测得4 mol SO2发生下列化学反应:2SO2(g)+O2(g) 2SO3(g)ΔH=-196.64 kJ/mol。当放出314.3 kJ热量时,SO2转化率最接近于()。
2SO3(g)ΔH=-196.64 kJ/mol。当放出314.3 kJ热量时,SO2转化率最接近于()。
| A.40% | B.50% | C.80% | D.90% |
在一容积可变的密闭容器中,aA(气)  bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
| A.平衡向正反应方向移动 | B.物质A的转化率减少 |
| C.物质B的质量分数减小 | D.化学计量数关系a>b |