“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 _______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式: 。
钠是活泼金属的代表,钠和钠的化合物是中学化学的基础知识。请回答下列有关问题。
(1)钠跟水剧烈反应,生成和氢气(H2),此实验说明钠的化学性质活泼;
(2)钠有两种氧化物,其中能用于呼吸面具和潜水艇中作为氧气来源的氧化物是;
(3)固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是(填“萃取”或“加热”或“蒸馏”)。
根据乙烯和乙醇的知识填空。
(1)完成下列化学方程式:CH2= CH2+ CH3CH2OH;
CH3CH2OH;
(2)实验室,乙醇跟乙酸在浓硫酸催化且加热的条件下反应,制取的是。
现有以下四种物质:
| A.新制的氢氧化铜[Cu(OH)2]悬浊液 | B.碳铵(NH4HCO3) |
| C.明矾[ KAI(SO4)2·12H2O] | D.熟石灰[Ca(OH)2] |
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验尿液中是否含有葡萄糖,可使用;
(2)要使含泥沙的洪水变澄清,可使用;
(3)要中和钢铁厂、电镀厂产生的酸性废水,可使用;
(4)给农作物施用氮肥,可使用。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲通入过量CO2后生成沉淀F的离子反应方程式为______________________________________。
(2流程乙加入烧碱溶解SiO2的化学反应方程式____________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途____________________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=12,则此温度下残留在溶液中的c(Mg2+)=________________。
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。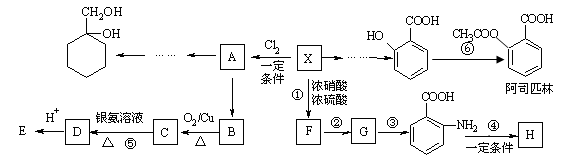
已知:
Ⅰ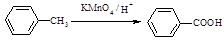
Ⅱ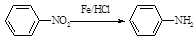 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)H的结构简式是______________;(2)反应②的类型是______________;
(3)反应⑤的化学方程式是____________________________________________;
反应⑥的化学方程式是____________________________________________;
(4)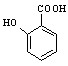 有多种同分异构体,其中符合下列条件的共有__________种
有多种同分异构体,其中符合下列条件的共有__________种
①能发生银镜反应但不能水解
②每摩尔同分异构体最多消耗2mol NaOH
③苯环上一氯代物只有两种