下列说法正确的是
| A.7.8克Na2S和Na2O2的固体混合物中含有的阴离子数目为0.1NA |
B.用铜做电极电解CuSO4溶液的反应方程式: 2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C.常温时,浓度均为0.01mol/L的 Na2CO3溶液和NaHCO3溶液等体积混合,其溶液中粒子浓度关系为c(CO32-) +c(HCO3-)+c(H2CO3) =0.02mol/L |
| D.在蒸馏水中滴加浓H2SO4,KW不变 |
某温度下,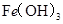
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的辩护如图所示。据图分析,下列判断错误的是
A.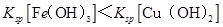 |
B.加适量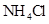 固体可使溶液由 固体可使溶液由 点变到 点变到 点 点 |
C. 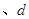 两点代表的溶液中 两点代表的溶液中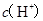 与 与 乘积相等 乘积相等 |
D. 、 、 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
| A.0.3mol NO2和0.3mol NO | B.0.2mol NO2和0.1mol N2O4 |
| C.0.1mol NO、0.2mol NO2和0.05mol N2O4 | D.0.6mol NO |
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O +O2+4OH-=Fe3O4+S4O
+O2+4OH-=Fe3O4+S4O +2H2O,下列说法正确的是()
+2H2O,下列说法正确的是()
A.O2和S2O 是氧化剂,Fe2+是还原剂 是氧化剂,Fe2+是还原剂 |
| B.每生成1mol Fe3O4,则转移电子数为2mol |
| C.参加反应的氧化剂与还原剂的物质的最之比为1:1 |
| D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
将PH=3的强酸溶液和PH=12的强碱溶液混合,当混合液的PH等于11时,强酸与强碱溶液的体积比是()
| A.10∶1 | B.1∶9 | C.9∶2 | D.9∶1 |
在10 mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是()
| A.C(Na+)>C(Ac-)>C(H+)>C(OH-) | B.C(Na+)>C(Ac-)> C(OH-) > C(H+) |
| C.C(Na+)= C(Ac-)+ C(HAc) | D.C(Na+)+ C(H+)= C(Ac-)+ C(OH-) |