某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
| 物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
| 沸点/℃ |
64.7 |
249 |
199.6 |
| 相对分子质量 |
32 |
122 |
136 |
Ⅰ.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g苯甲酸和20mL 甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用 ,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式: ,甲醇过量的原因 。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用 装置(填“甲”、“乙”、“丙”)。 
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为 ,操作II为 。
(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是 。
(6)苯甲酸甲酯的产率为 。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
 Ⅰ.测定过氧化的含量
Ⅰ.测定过氧化的含量
 请填写下列空白:
请填写下列空白:
(1)
 移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)
 用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3)



 (3)滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________________
(3)滴定时,将高锰酸钾标准溶液注入______________________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________________________________
 ______________________________________________________________。
______________________________________________________________。
 (4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________________________________。
 (5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。



 Ⅱ.探究过氧化氢的性质
Ⅱ.探究过氧化氢的性质




 该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
该化学小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
 请将他们的实验方法和实验现象填入下表:
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
| 验证氧化性 |
||
| 验证不稳定性 |
浓H2SO4和木炭在加热时发生反应的化学方程式是



 2 H2SO4 (浓) + C
2 H2SO4 (浓) + C  CO2↑+ 2 H2O + 2SO2↑
CO2↑+ 2 H2O + 2SO2↑ 请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻
璃管、胶管、铁夹、铁架台及加热装置等均略去)

 将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。

选用的仪器 (填字母) (填字母) |
加入的试剂 |
作用 |
    |
氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解。请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
 (1)某同学提出的假设是 ;
(1)某同学提出的假设是 ; (2)通过实验Ⅰ可以证明 ;
(2)通过实验Ⅰ可以证明 ; (3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入 ,再加入 。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认为:在Ⅲ中先加入 ,再加入 。 (4)探究结果为 。
(4)探究结果为 。 (5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
(5)你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是 。
写出浓硫酸与木炭粉在加热条件下反应的化学方程式,并标出电子转移关系 。





 (2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → →
(2)试用上图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气体从左至右的流向)是(填装置的编号): → → → 。
。 (3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。
(3)实验室可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是 ,B瓶溶液的作用是 ,C瓶溶液的作用是 。 (4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。
(4)装置②中所加的固体药品是 ,可确证的产物是 ,确定装置②在整套装置中的位置的理由是 。 (5)装置③中所盛溶液是 ,可验证的产物是
(5)装置③中所盛溶液是 ,可验证的产物是 
根据下图所示实验回答下列问题:
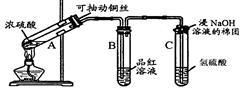
 (1)试管C口部的棉团上发生反应的离子方程式是 。
(1)试管C口部的棉团上发生反应的离子方程式是 。 (2)试管B中的实验现象是 ,若将该试管中反应后的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。
(2)试管B中的实验现象是 ,若将该试管中反应后的溶液加热,可以观察到 。试管C中溶液变浑浊,则证明SO2具有 性。 (3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液,则发生反应的化学方程式是 。
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是 ,如果浸NaHCO3溶液,则发生反应的化学方程式是 。