工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是 ( )。
A.2SO3(g)  2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1 2SO2(g)+O2(g)ΔH=+196.6 kJ·mol-1 |
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=+98.3 kJ·mol-1 SO3(g)ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g)ΔH=-196.6 kJ·mol-1 SO3(g)ΔH=-196.6 kJ·mol-1 |
下列说法中正确的是( )
| A.一定条件下下向1L容器内通入46gNO2 ,则NO2 的物质的量浓度一定为1mol/L |
| B.标准状况下,22.4L的己烷中有20 x 6.02 x 1023个原子 |
| C.1mol氯气溶于水转移 6.02 x 1023个e- |
| D.0.1mol CH5+含6.02×1023个电子 |
常温,下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1的溶液中: I-、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)="0.1" mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是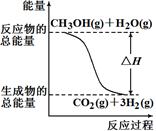
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )
| A.反应①中的能量变化如右图所示 |
| B.CH3OH转变成H2的过程一定要吸收能量 |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.可推知2H2(g)+O2(g)=2H2O(g)∆H=-483.8 kJ/mol |
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是( )
| A.CO2是氧化产物 |
| B.H2C2O4在反应中被氧化 |
| C.1mol KClO3参加反应,转移的电子为1mol |
| D.H2C2O4的氧化性强于ClO2的氧化性 |
下列离子方程式书写正确的是( )
A.碳酸钠溶液滴入酚酞变红: CO32- + 2H2O 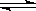 H2CO3 + 2OH- H2CO3 + 2OH- |
| B.铜溶解于氯化铁溶液中:2Fe3++3Cu=2Fe+3Cu2+ |
| C.氯化铝溶液与过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.FeSO4溶液中滴入稀硝酸:3Fe2+ + 4H+ + NO3- = 3Fe3+ + 2H2O + NO↑ |