甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)=CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________________________。
物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。C是一种气体,D是白色胶状沉淀,E是白色固体。A、B、C、D、E间的转化关系如右图所示:
(1)写出A、B、C、D、E的化学式:
A____________、B____________、C____________、D____________、E____________。
(2)写出下列变化中的有关反应方程式:
①B+C D:_________________________________。
D:_________________________________。
②E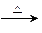 A:_________________________________。
A:_________________________________。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96 g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 mol KMnO4的酸性溶液, 恰好完全被还原为Mn2+。
恰好完全被还原为Mn2+。
请完成以下问题:
(1)该结晶水合物中含有的两种阳离子是___________和___________,阴离子是
___________。
(2)试通过计算确定该结晶水合物的化学式为
________________________________________。
已知A、B、C、D、E、F、G七种物质有如图所示的转化关系(从A、B开始),其中B为红色固体,D为紫红色固体,E为气体。请完成下列问题: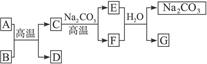
(1)当G为白色不溶于硝酸的沉淀时,A为_____________,B为_____________,C为_____________,F为_____________。
(2)当G为白色可溶于盐酸的沉淀且E、F反应生成G和NaHNO3时,A为_____________,D为_____________,F为_____________,G为_____________。
3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O反应中,_________是氧化剂;_________是还原剂;_________元素被氧化;_________元素被还原;_________是氧化产物;_________是还原产物;被还原的HNO3与参加反应的HNO3物质的量之比是_________。
将下列离子Na+、K+、Cu2+、H+、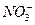 、Cl-、
、Cl-、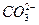 、OH-按可能大量共存于同一溶液的情况,把它们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
、OH-按可能大量共存于同一溶液的情况,把它们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:_______________________________________;
B组:_______________________________________。