在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1 100 |
841 |
689 |
533 |
409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=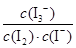
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
下列物质中所含分子数一定相等的是
| A.等体积的一氧化碳和氮气 | B.11.2L氧气和0.5mol氢气 |
| C.0.5mol二氧化碳和6.02×1023个水分子 | D.14g氮气和0.5mol氨气 |
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为( )
| A.1∶1∶1 | B.1∶2∶3 | C.3∶2∶1 | D.6∶3∶2 |
某未知溶液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水中,石灰水变浑浊,已知该溶液中含有阴离子是如下四组中的一组。则它是()
| A.Cl-SO42- | B.Cl-NO3- | C.Cl-CO32- | D.Cl-OH- |
在配制100mL 2mol/L的NaOH溶液时,下列操作会导致结果偏低的是( )
(1)用拖盘天平称量时砝码放在左盘
(2)溶解NaOH固体后没有冷却至室温就向容量瓶转移溶液
(3)将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
(4)定容时俯视刻度线
(5)定容时仰视刻度线
(6)干净的容量瓶未经干燥就用于配制溶液
| A.(2)(4)(6) | B.(1)(3)(4) |
| C.(1)(3)(5) | D.(2)(3)(4) |
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是( )
| A.分液漏斗 | B.普通漏斗 |
| C.蒸馏烧瓶 | D.容量瓶 |