T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图(1)所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图(2)所示。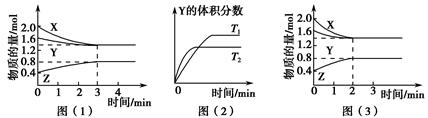
则下列结论正确的是 ( )。
| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1 |
B.容器中发生的反应可表示为3X(g)+Y(g) 2Z(g) 2Z(g) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图(3)所示,则改变的条件是增大压强 |
按照有机物的命名规则,下列命名正确的是
| A.CH2Br-CH2Br二溴乙烷 |
| B.CH3OOCCH3甲酸乙酯 |
C.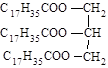 硬脂酸甘油脂 硬脂酸甘油脂 |
D.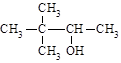 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
在非室温条件下可以使用的仪器是
| A.漏斗 | B.量筒 | C.容量瓶 | D.滴定管 |
关于汽油、甘油和花生油的叙述正确的是
| A.都属于油脂 | B.都无固定的沸点 |
| C.都能浮在水面上 | D.只有花生油能与氢氧化钠溶液反应 |
在5.6 g Fe粉中加入过量的稀硫酸溶液,待反应完全后,再加入1mol·L-1 KNO3溶液25mL,恰好反应完全。该反应的方程式为:
FeSO4 +KNO3 +H2SO4→K2SO4 +Fe2(SO4)3+NxOy+ H2O(未配平),则对该反应的下列说法正确的是
| A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
| B.反应中氧化产物是N2O |
| C.反应过程中转移的电子数为8mol电子 |
| D.氧化产物和还原产物的物质的量之比为4∶1 |
某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |