美国“海狼”潜艇上的核反应堆内使用了液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是 ( )。
| A.原子半径:Na>Al |
| B.若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na) |
| C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 |
| D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成 |
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )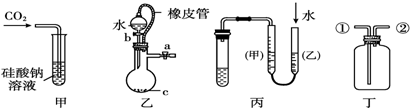
| A.甲装置:可用来证明碳的非金属性比硅强 |
| B.乙装置:橡皮管的作用是能使水顺利流下 |
| C.丙装置:用图示的方法不能检查此装置的气密性 |
| D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是()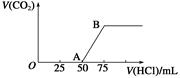
| A.OA段所发生反应的离子方程式: H++OH-=H2O;CO32-+H+=HCO3- |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1。 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
对下列过程中发生反应的叙述正确的是
| A.海水中含有钾元素,只需经过物理变化可以得到钾单质 |
| B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氯化物的方法来制备其单质 |
| C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应 |
| D.从海水中提取溴单质的过程中所涉及的反应均是置换反应 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是()
①原溶液中的Br-一定被氧化;
②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
下列各项内容中,排列顺序正确的是()
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-④单质的密度Na<K<Rb⑤氢化物的沸点:H2Se>H2S>H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |