已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)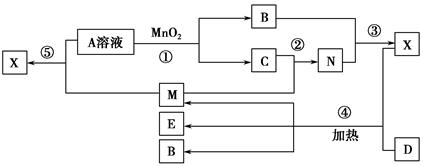
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
钛合金是航天航空工业的重要材料。由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)制备Ti等产品的一种工艺流程示意图如下:
已知:① TiO2+易水解,只能存在于强酸性溶液中。 ②常温下,难溶电解质溶解度与pH关系图。
③25 ℃时TiO(OH)2溶度积Ksp=1×10-29
回答下列问题:
(1)写出钛铁矿酸浸时,反应的离子方程式。
(2)操作Ⅱ包含的具体操作方法有。
(3)向“富含TiO2+溶液”中加入Na2CO3粉末的作用是, TiO2+水解的离子方程式为,当溶液pH= 时,TiO(OH)2已沉淀完全。
(4)加入铁屑将Fe3+转化为Fe2+的原因是。
工业上常利用CO和H2合成可再生能源甲醇。
(1)已知CO(g)、CH3OH(l)的燃烧热分别为283.0 kJ·mol-1和726.5 kJ·mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为。
(2)合成甲醇的方程式为CO(g)+2H2(g) CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。
在230 ℃〜270 ℃最为有利。为研究合成气最合适的起始组成比n(H2):n(CO),分别在230 ℃、250 ℃和270 ℃进行实验,结果如下左图所示。其中270 ℃的实验结果所对应的曲线是_____(填字母);当曲线X、Y、Z对应的投料比达到相同的CO平衡转化率时,对应的反应温度与投较比的关系是。
(3)当投料比为1∶1,温度为230 ℃,平衡混合气体中,CH3OH的物质的量分数为(保留1位小数);平衡时CO的转化率。
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H="-76.0" kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g)△H="+113.4" kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示:
①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
废钒催化剂的主要成分是V2O5、VOSO4、K2SO4、SiO2和Fe2O3等,现欲利用以下工艺流程回收V2O5。
回答下列问题:
(1) VOSO4中,V元素的化合价为_______,①中产生的废渣的主要成分是_________。
(2)配平④中反应的离子方程式:
(3)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表:
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为______________。
(4)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺流程中,可循环利用的物质还有________________。
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:______________________________________。
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。