“封管实验”具有简易、方便、节约、绿色等优点,观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 ( )。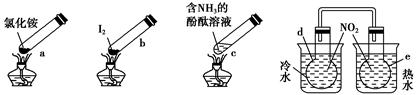
| A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.e内气体颜色变浅,d内气体颜色加深 |
按照物质的树状分类和交叉分类,HNO3应属于:①酸②氢化物③氧化物④含氧酸⑤一元酸⑥强酸⑦化合物⑧有机物⑨无机化合物
| A.①④⑤⑥⑦⑨ | B.①②③④⑤⑥⑦⑨ | C.①②④⑧ | D.①④⑤⑥ |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是()
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)="4NO" (g) +CO2 (g)+2H2O (g) ;△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g);△H=―1160 kJ·mol一1。
下列选项正确的是()
| A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1 |
| B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
某温度下反应N2O4(g) 2NO2 (g);ΔH>0,在密闭容器中达平衡,下列说法正确的是()
2NO2 (g);ΔH>0,在密闭容器中达平衡,下列说法正确的是()
| A.保持体积不变,加入少许N2O4,平衡向逆反应方向移动 |
| B.升高温度v正、v逆都增大,v正增大的倍数小于v逆增大的倍数 |
| C.保持体积不变,升高温度,再达平衡时混和气体颜色变深 |
| D.达到平衡后,降低温度或减小压强平衡移动的方向一致 |
在一密闭容器中有如下反应:L (s) + a G (g) b R (g) 温度和压强对该反应的影响如右图所示。
b R (g) 温度和压强对该反应的影响如右图所示。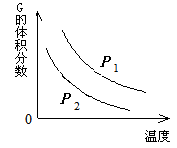
其中压强P1 < P2,由此可判断()
| A.正反应为放热反应 |
| B.化学方程式中的计量数a>b |
| C. G的转化率随温度升高而减小 |
| D.增大压强,容器内气体质量不变 |