铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是( )
Fe2++Cr3+。下列说法一定正确的是( )
| A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
下列无色溶液中的离子能大量共存的是
| A.K+、Na+、MnO4-、SO42- | B.H+、K+、NO3-、SO32- |
| C.Na+、Ba2+、Cl-、Br- | D.Fe3+、NH4+、SCN-、HCO3- |
下列说法不正确的是
| A.氯乙烯、聚乙烯、苯乙烯都是不饱和烃 |
| B.蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出 |
| C.苯能与溴在一定条件下发生取代反应 |
| D.淀粉和纤维素水解的最终产物都是葡萄糖 |
已知C—C键可以绕键轴自由旋转,对于结构简式为下图所示的烃,下列说法中正确的是 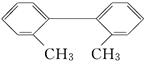
| A.分子中至少有8个碳原子处于同一平面上 |
| B.分子中至少有9个碳原子处于同一平面上 |
| C.该烃苯环上的一氯取代物最多有四种 |
| D.该烃是苯的同系物 |
某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,则下列说法中正确的是
| A.混合气体中一定有乙炔 | B.混合气体中一定有乙烯 |
| C.混合气体可能由乙炔和丙烯组成 | D.混合气体一定由乙烯和乙炔组成 |
10mL某气态烃在80mL O2中充分燃烧,得到液态水和体积为65mL的混合气体(气体体积均在相同条件下测定),该气态烃不可能是
| A.丙烷 | B.乙烷 | C.丙烯 | D.甲烷 |