已知X、Y在一定条件下发生反应,可以得到E、F、G。下列假设与结论能对应成立的是( )
| 选项 |
假设 |
结论 |
| A |
若X、Y均为固体,E为气体 |
则E一定能使湿润的蓝色石蕊试纸变红 |
| B |
若该反应是氯碱工业的主要反应,反应一段时间后 |
两极产生的气体体积可能不同(不考虑气体的溶解) |
| C |
若X为单质,Y为氧化性酸,气体E是能引起酸雨的主要物质 |
则Y一定是浓H2SO4 |
| D |
若X为有机物,得到E是一种红色沉淀 |
则X一定是醛 |
下列关于化学反应限度的说法中不正确的是
| A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 |
| B.当一个可逆反应进行到平衡状态时,那么这个反应的正向反应速率和逆向反应速率相等 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 |
| D.化学反应的限度可以通过改变条件而改变 |
A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
决定化学反应速率的主要因素是
| A.参加反应的物质本身的性质 |
| B.催化剂 |
| C.温度、压强以及反应物的接触面 |
| D.反应物的浓度 |
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是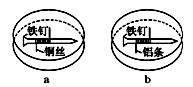
| A.a中铁钉附近呈现红色 | B.b中铁钉上发生还原反应 |
| C.a中铜丝上发生氧化反应 | D.b中铝条附近有气泡产生 |
下列反应属于吸热反应的是
| A.稀硫酸与氢氧化钾溶液反应 |
| B.氢气还原氧化铜的反应 |
| C.锌与稀硫酸的反应 |
| D.生石灰变成熟石灰的反应 |