一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。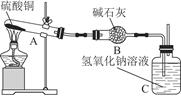
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.5 g |
140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B. 3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是()
| 操作 |
现象 |
结论 |
|
| A |
先滴加BaCl2溶液,再加稀HNO3 |
生成白色沉淀, 且沉淀不溶解。 |
原溶液中有SO42- |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫红色 |
原溶液中有I― |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加NaOH溶液加热,将红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
| A.该未知物X为Na2SO4 |
| B.该反应的氧化剂是KIO3 |
| C.该反应中,发生氧化反应的过程是KIO3→I2 |
| D.由反应可知还原性强弱顺序为:Na2SO3>I2 |
设NA为阿伏加德罗常数。下列叙述不正确的是
| A.标准状况下,2.24 L Cl2完全溶于足量的水中,转移电子的数目为0.1NA |
| B.常温常压下,11.0g C3H8中含有共价键的数目为2.5NA |
| C.常温常压下,1 L 0.1 mol·L-1 NH4NO3溶液中NO3-的数目为0.1NA |
| D.30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
下列化学药品中的试剂瓶上所贴化学危险品标志有错误的是
| A |
B |
C |
D |
|
| 物质 |
Na2O2 |
三硝基甲苯 |
浓H2SO4 |
CCl4 |
| 危险警告标识 |
 |
 |
 |
 |
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。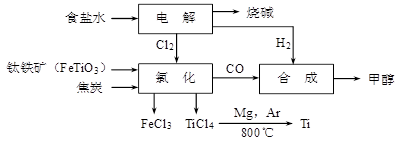
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式。
(3)氯碱厂获得Cl2的离子方程式为
| TiCl4 |
Mg |
MgCl2 |
Ti |
|
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。