硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。
Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准 |
|
|
|
|
| 溶液的体积/mL |
18.02 |
17.98 |
18.00 |
20.03 |
部分反应离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-。
则判断达到滴定终点的现象是 ,废水中Ba2+的物质的量浓度 _。
在加热条件下,浓H2SO4 可与食盐制取浓HCl、浓HCl可与KMnO4制取C
可与食盐制取浓HCl、浓HCl可与KMnO4制取C l2,选用
l2,选用 下图所示装置(含有所盛放的试剂)设计实验。
下图所示装置(含有所盛放的试剂)设计实验。
(1)写出上述制取浓 HCl,Cl2的化学反应方程式:
HCl,Cl2的化学反应方程式:
______________________________________________________;
______________________________________________________。
(2)用仪器间相互连接处的数字,表示四种仪器之间的连接顺序:
_____ _________________________________。
_________________________________。
(3)上图C中的饱和食盐水的作用是;
B中的氢氧化钠溶液的作用是。
(4)反应装置D中有一处连接错误是;
实验装置中有Cl2生成的现象是;
(5)写出氯气与氢氧化钠溶液反应的化学方程式
实验室欲配制100 mL 0.92 mol•L-1的H2SO4溶液(本小题每空2分,共14分)
(1)需要用到的仪器,除了烧杯、空试剂瓶、玻璃棒、量筒、还必须有;
(2)若提供的是18.4 mol•L-1的浓H2SO4,求所需量取的浓H2SO4的体积为mL;
(3 )对配制过程中的下列说法,正确的是。(填序号,多选、少选均不得分)
)对配制过程中的下列说法,正确的是。(填序号,多选、少选均不得分)
| A.量筒量取浓硫酸后要冲洗并将冲洗液一起倒入小烧杯 |
| B.量好体积的浓硫酸应先倒入小烧杯中然后再加水稀释 |
| C.稀释好的稀硫酸要立即转移入容量瓶 |
| D.若定容后摇匀液面又下降了。则必须再补加水至刻度线。 |
(4)配制稀硫酸的容量瓶必须洗涤,若用含有蒸馏水的容量瓶未干燥就配制稀硫酸,
则所配稀硫酸浓度将(偏高、偏低、不变);若用刚配制过NaOH
溶液的容量瓶未洗涤就配制稀硫酸,则所配制的稀硫酸溶液的浓度将
(偏高、偏低、不变);若用刚配制过HCl溶液的容量瓶未洗涤就配制稀硫酸,则
所配制稀硫酸浓度将(偏高、偏低、不变),
氢离子浓度将(偏高、偏低、不变)。
某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是。用离子方程式解释产生气泡的原因:。
⑶放出的气体是,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
| A |
正极 |
NaOH |
Al-3e-=Al3+ |
2H2O+2e-=2OH-+H2↑ |
| B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
| C |
正极 |
浓硝酸 |
Cu-2e--=Cu2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
| D |
负极 |
稀硝酸 |
Cu-2e-=Cu2+ |
2NO3-+8H+=2NO↑+4H2O+6e- |
其中正确的是,由此推知,金属作电极不仅与本身性质相关,而且与 ________有关。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.0 0mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
0mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和(填字母)。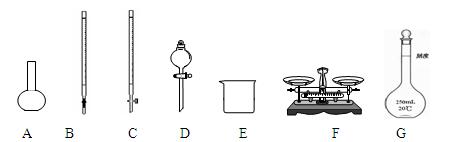
(2)步骤②加入盐酸的目的是;加快样品溶解的最简单操作是。
(3)写出步骤③中发生反应的离子方程式。
(4)步骤⑤的洗涤是洗去附着在沉淀上的(写离子符号),洗涤沉淀的操作。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为。
)某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案: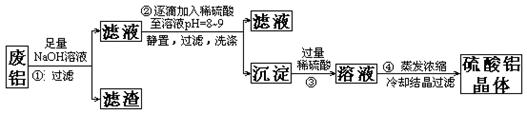
请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:
;
(3)评价步骤②的操作中难以控制之处,请你提出一个合理而比较容易操作的实验方案(药品可任选)
;
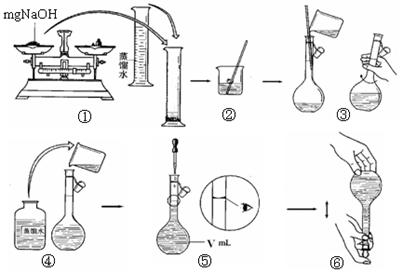
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制
V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号)。