某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。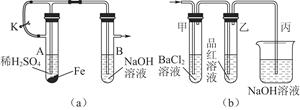
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是
。
②为达到实验目的,正确的操作是 。
B管中发生反应的离子方程式是 。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因
。
②为验证红棕色固体成分,可进行如下操作
。
③图(b)中丙装置的作用是 。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式 。
实验室欲配制80mL 2mol?L?1的KCl溶液,就配制该溶液的过程回答下列各小题:
(1)不需要的仪器是。
A.烧杯B.100mL容量瓶C.量筒D.胶头滴管E.玻璃棒F. 50mL容量瓶
(2)配制时应称取KClg。
(3)下列操作的正确顺序是(用字母表示)。
A.冷却 B.称量C.洗涤 D.定容E.溶解F.摇匀 G.转移
(4)若容量瓶未干燥即用来配制溶液,实验结果将;若定容时俯视刻度线,实验结果将。(均填“”、“偏低”或“无影响”)
某学生需要用烧碱固体配制0.5 mol·L-1的NaOH溶液500mL。实验室提供以下仪器:①100mL烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)。请回答下列问题:
(1)计算结果:需要称取NaOH固体g;
(2)配制时,必须使用的仪器有____________(填代号),
还缺少的仪器是、 。(填仪器名称)
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)______________________;
| A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
| B.在盛有NaOH固体的烧杯中加入适量水溶解 |
| C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,反复上下颠倒,摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)实验两次用到玻璃棒,其作用分别是:先用于________、后用于________;
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A
④加蒸馏水时不慎超过了刻度
(6)若实验过程中出现(5)中④这种情况你将如何处理?。
对于混合物的分离或提纯,常采用的方法有:
过滤②蒸发结晶③蒸馏④萃取⑤洗气⑥加热分解等。
选用合适的方法序号填空。
(1)实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
(2)除去H2中的CO2,可用的方法除去。
(3)为了从氯化钾和二氧化锰的混合物中获得氯化钾,可先加足量的水溶解,过滤,将得到的滤液,就可得到氯化钾晶体。
(4)除去氧化钙中的碳酸钙,可用的方法。
(5)从溴水中提取溴单质,可用方法。
(6)分离沸点相差较大的液体混合物,可用方法。
14分) DIS(Digital Information System)系统即数字化信息系统,它由传感器、数据采集器和计算机组成。DIS系统为化学教学提供了全新的技术手段和教学平台。某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。
实验步骤如下:
(1)用______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如右图),向烧杯中滴加浓度为0.1000mol·L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用____________润洗2~3遍,润洗的目的是____________。
②溶液导电能力随氨水体积变化的原因是___________________ _____________________。
③食用白醋中醋酸的物质的量浓度是_____________。
某化学课外小组用海带为原料制取少量碘水,已知:海带中碘元素以I—形式存在。提取碘的原理是“在酸性条件下用H2O2将I—氧化为碘单质”。
反应后,再进行以下实验步骤:
①把盛有溶液的分液漏斗放在铁架台的铁圈中;②把50mL碘水和15mL CCl4加入分液漏斗中,盖好玻璃塞,倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞把分液漏斗放正;③检验分液漏斗活塞和上口的玻璃塞是否漏液;④旋开分液漏斗活塞,用烧杯接收下层液体;⑤从分液漏斗上口倒出上层液体;⑥将漏斗上口的玻璃塞打开或使塞上凹槽对准漏斗口上的小孔;⑦静置,分层。
就此实验,完成下列填空:
(1)写出用海带制取单质碘的离子方程式:______________ ______________________ 。
(2)正确的实验操作步骤顺序为: ® ® ®⑥®⑦®④®⑤。
⑶第②步操作的名称是_______ _____,
⑷第②步中,可以用来替代CCl4的溶剂有:
| A.汽油 | B.酒精 | C.苯 | D.水 |