对乙酰氨基苯酚F(CH3C—NHOOH)是常用的非甾类消炎解热镇痛药。F可用如下路线来合成:
(1)若A分子的核磁共振氢谱只有一个吸收峰,且能使溴水褪色,则A的结构简式为 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)F的同分异构体有多种,写出两种满足下列条件的F的同分异构体的结构简式。
①苯环上有两个取代基;
②苯环上的一卤代物只有两种;
③能发生水解反应,水解产物之一遇FeCl3溶液显色。
、 。
(4)F在NaOH溶液中水解的化学方程式为 。
(5)D的同分异构体W结构简式为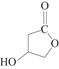 。下列关于W的说法正确的是( )
。下列关于W的说法正确的是( )
a.可与HBr反应生成溴代物
b.可发生消去反应,消去产物有两种
c.1 mol发生催化氧化反应后的产物可与2 mol H2发生加成反应
d.常温下可与Na2CO3溶液反应
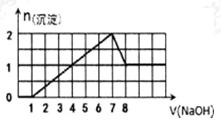
(1)某溶液中可能含H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42﹣,CO32﹣离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如下左图所示:溶液中一定存在的阳离子为 ,其物质的量之比 可能存在的阳离子如何用实验确定 。
(2)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如上右图所示
①曲线A、B的转折点为什么在一条垂直线上
②曲线B的溶质为
③A溶液最多还能吸收CO2体积(标况)为 mL
在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。写出其分解的化学方程式_____________ _____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:____________________。
(3)写出过量F通入A中生成沉淀的离子方程式:______________。
(4)每生成1 mol D(固体),同时生成_________mol E。
(1)在常温下,发生下列几种反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z-
根据上述反应,XO4-、Z2、B2、A3+氧化性从强到弱的顺序为:
(2)已知KMnO4与浓盐酸发生如下反应:
2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑+8H2O。
在上述反应中,氧化产物和还原产物物质的量之比是 。用单线桥法标出此反应的电子转移方向和数目 。
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个配平的化学方程式:
________+________+ H2SO4→ ________+________+________(填化学式)
②反应中1mol氧化剂得到______mol电子。
(1)下列物质中,能导电的是 ,属于电解质的是 (填序号)。
①Cu、②液氨、③氯化钠晶体、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石.
(2)将等物质的量的①Na、②Na2O、③Na2O2、④NaOH投入相同质量的水中,所得溶液浓度由大到小的顺序为 。如果将等物质的量换成等质量则 。(填序号)
(3)用氯化铝溶液与氢氧化钠溶液反应时,当Al3+离子的物质的量与OH-离子的物质的量之比(以下均填物质的量之比)为__________或________时Al(OH)3沉淀量为最多沉淀量的1/4。
(1)有下列物质①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦BaSO4属于弱电解质的是________________(填序号);
(2)常温下,0.1 mol•L-1NaHCO3溶液的pH大于8,则溶液中的Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________;NaHCO3水解的离子方程式为_____________;
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol•L-1) |
NaOH物质的量浓度(mol•L-1) |
混合溶液的pH |
| a |
0.1 |
0.1 |
pH=9 |
| b |
c |
0.2 |
pH=7 |
请回答:
①从a组情况分析,HA是强酸还是弱酸____________;
②b组情况表明,c_____0.2 (选填“>”、“<”或“=”).混合溶液中离子浓度c(A-)_________c(Na+);(选填“>”、“<”或“=”)
③a组实验所得混合溶液中由水电离出的c(OH-)=_______mol•L-1。