下列有关化学用语表示正确的是
A.CO2的分子比例模型: |
B.质量数为37的氯原子: |
C.Mg2+结构示意图: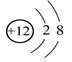 |
D.NH4Cl的电子式: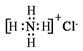 |
铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为()
| A.Fe(OH)3,Fe2O3 | B.Fe(OH)2,FeO |
| C.Fe(OH)2、Fe(OH)3,Fe3O4 | D.Fe2O3,Fe(OH)3 |
曾在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。以下叙述正确的是()
| A.铝热剂就是指Fe2O3粉末和铝粉的混合物 |
| B.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C.分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3∶2∶3 |
| D.明矾属硫酸盐,是纯净物 |
某溶液含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝,可供选择的操作有:
①加适量H2SO4溶液②加金属钠③结晶
④加过量NaOH溶液⑤加强热脱结晶水
⑥过滤,其正确的操作步骤是()
| A.②⑥③ | B.④⑥①③ |
| C.②⑥③⑤ | D.②⑥①③ |
在含有a g硝酸的稀溶液中,加入b g铁粉充分反应,铁全部溶解生成NO,有a/4 g HNO3被还原,则a∶b不可能为()
| A.2∶1 | B.3∶1 |
| C.4∶1 | D.9∶2 |
将Cu片放入01 mol·L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为()
| A.3∶2 | B.3∶5 |
| C.4∶3 | D.3∶4 |