下列离子方程式书写正确的是
| A.钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| B.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| C.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| D.FeI2溶液中通人少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
对于放热反应2H2+O2 2H2O,下列说法正确的是( )
2H2O,下列说法正确的是( )
| A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 |
| B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 |
| C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 |
| D.反应物H2和O2具有的能量相等 |
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
H-H |
Cl-Cl |
H-Cl |
| 生成1mol化学键时放出的能量 |
436kJ·mol-1 |
243kJ·mol-1 |
431kJ·mol-1 |
则下列热化学方程式不正确
A.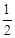 H2(g)+
H2(g)+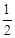 Cl2(g)=HCl(g);△H=-91.5 kJ·mol-1
Cl2(g)=HCl(g);△H=-91.5 kJ·mol-1
B. H2(g)+Cl2(g)=2HCl(g);△H=-183 kJ·mol-1
C.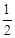 H2(g)+
H2(g)+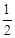 Cl2(g)=HCl(g);△H=+91.5 kJ·mol-1
Cl2(g)=HCl(g);△H=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g);△H=+183 kJ·mol-1
在25℃101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为
P4(s)+5O2(g)= P4O10(s);△H = -3093.2 kJ/mol
4P(s)+5O2(g)= P4O10(s);△H = -2954.0 kJ/mol
由此判断,下列说法正确的是
| A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高 |
| B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低 |
| C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高 |
| D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低 |
下列四种x的溶液,分别加入盛有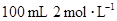 盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是
盐酸的烧杯中,并加入水稀释至500mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是
A.20 mL,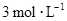 |
B.20 mL,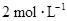 |
C.10 mL,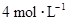 |
D.10 mL,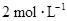 |
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=+890kJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890kJ·mol-1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1 |
| D.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-890kJ·mol-1 |