某化学兴趣小组的同学利用下图所示实验装置进行实验。(图中a、b、c表示止水夹)。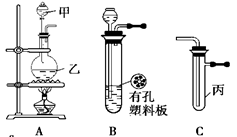

请按要求填空:
(1)利用B装置可制取的气体有 (至少填2种),写出实验室里利用A装置制取氯气的离子方程式 。
(2)只用A、C、E相连后的装置用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 |
实验操作 |
现 象 |
结 论 |
| Ⅰ |
将氯水滴入品红溶液 |
溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
氯水中加入 NaHCO3粉末 |
有无色气泡产生 |
氯气与水反应的产物具有较强的酸性 |
①请评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。 (任选1个实验进行评价。)
| 实验序号 |
结论 |
理由 |
| Ⅰ |
|
|
| Ⅱ |
|
|
②若要利用上述A、C装置设计一个简单的实验,验证Cl2和I2的氧化性强弱,可以在甲、乙、丙中分别装入浓盐酸、MnO2、淀粉碘化钾溶液,根据丙中产生的现象是 ,则可证明Cl2的氧化性强于I2 。
(3)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式 。
② 欲用D装置验证NO2与水的反应,其操作步骤:先关闭止水夹 (填写a、b或c),再打开止水夹 (填写a、b或c),若要使D烧杯中的水进入试管丁的操作是:通过 试管丁,使试管丁的NO2气体逸出,NO2与水接触后即可引发烧杯中的水倒流进入试管丁。
硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是______________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是__________________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是____________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。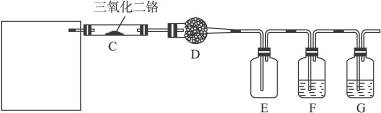
有甲、乙两位同学想利用下列装置及化学试剂,对实验室制取并收集氨气的实验进行改进。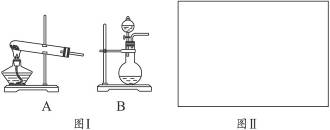
化学试剂:①NH4Cl固体 ②浓氨水 ③固体NaOH
(1)甲同学想方便快速制取少量氨气,应选择的装置是_________ (填序号)。
选用试剂是_________(填序号),选用上述试剂制氨气的理由是________________________。
(2)乙同学建议,把教材中实验室制取氨气的收集装置由大试管改为集气瓶且瓶口向上收集氨气,并确保不污染环境,请你根据其设想完成问题:
若用排气法收集氨气,请在图Ⅱ的方框内画出其气体收集装置和尾气吸收装置,标出所用试剂(自选)名称。
实验室用如图所示装置分离CO2和CO气体并干燥。请完成(1)—(2)两个小题。
图3-9
(1)图中a为止水夹,b为分液漏斗的活塞,通过Y形管和止水夹c、d分别接两球胆。现装置内的空气已排尽。为使实验成功,甲、乙、丙分别盛放的溶液是()
A.NaHCO3饱和溶液、12 mol·L-1盐酸、18.4 mol·L-1 H2SO4
B.NaOH饱和溶液、2 mol·L-1 H2SO4、18.4 mol·L-1 H2SO4
C.Na2CO3饱和溶液、2 mol·L-1 H2SO4、NaOH饱和溶液
D.18.4 mol·L-1 H2SO4、NaOH饱和溶液、18.4 mol·L-1 H2SO4
(2)①打开a ②打开b ③打开c ④打开d,为了使气体分离,下列打开止水夹(或活塞)的顺序正确的是(关闭的步骤省略,只要打开的步骤)()
A.①④②③ B.①②③④
C.②①③④ D.③④①②
(1)等物质的量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是______。
(2)等质量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是__________。
(3)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量之比是__________。
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的质量之比是_______________。
已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c( )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c( )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为__________(填序号)。
(2)若四种离子的关系符合③,则溶质为__________;若四种离子的关系符合④,则溶质为__________ 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是__________(填图象符号)。

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
(5)如右图所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是___________,正极反应式是______________。