(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表:
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图:
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1) 用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) ="4NO(g)" + CO2(g) +2H2O(g)⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g)⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l)△H=" -44.0" kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 浓度/mol·L-1 浓度/mol·L-1
时间/min |
NO |
N2 |
CO2 |
||
| 0 |
1.00 |
0 |
0 |
||
| 10 |
0.58 |
0.21 |
0.21 |
||
| 20 |
0.40 |
0.30 |
0.30 |
||
| 30 |
0.40 |
0.30 |
0.30 |
||
| 40 |
0.32 |
0.34 |
0.17 |
||
| 50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B. 2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在下图中画出30min至40min的变化曲线。
磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
已知:2LiAl(SiO3)2 + H2SO4(浓)  Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| 温度/℃ |
20 |
40 |
60 |
80 |
| 溶解度(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| 溶解度(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式。
(2)滤渣Ⅱ的主要成分是:(填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)写出在高温下生成磷酸亚铁锂的化学方程式。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为。
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 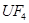 +
+  ——
——  +
+ 
②  +
+  ——
——  +
+ 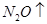 +
+ 
2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任。醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒。乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃。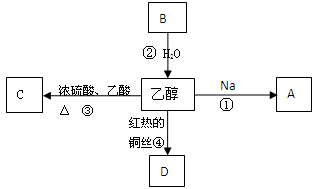
回答下列问题:
(1)物质B的电子式:,C的结构简式:。
(2)写出下列化学反应方程式及反应类型(有机物用结构简式):
反应①:,反应类型:。
反应②:,反应类型:。
反应③:,反应类型:。
反应④:,反应类型:。
(3)炒菜时,加一点酒和醋能使菜味香可口,原因是()
A.有盐类物质生成B.有醇类物质生成
C.有酯类物质生成D.有酸类物质生成
某温度时, 在一个0.5 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。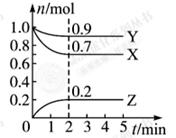
根据图中数据回答下列问题:
(1)该反应的化学方程式为。
(2)反应开始至2 min,以气体Z表示的平均反应速率为。
(3)用物质X表示的化学反应速率为0.2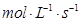 与用物质Y表示的化学反应速率为0.1
与用物质Y表示的化学反应速率为0.1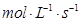 ,哪个快?()
,哪个快?()
a.前者 b.后者 c.一样快 d.无法比较
(4)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时(填“增大”“减小”或“相等”)。