从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应,有10 mol电子转移 |
| C.产物中的SO42-有一部分是氧化产物 |
| D.FeS2只作还原剂 |
关于下图所示各装置的叙述中,正确的是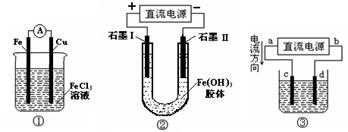
| A.装置①是原电池,总反应是:Cu + 2Fe3+ = Cu2+ + 2Fe2+ |
| B.装置①中,铁做负极,电极反应式为:Fe3+ + e- = Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
在一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后恢复到原来的温度,下列说法正确的是
| A.溶液的pH增大,有O2放出 |
| B.溶液的pH不变,有O2放出 |
| C.溶液中的c(Na+)增大,有O2放出 |
| D.溶液中的c(Na+)减小,有O2放出 |
已知①2C(s)+O2(g)====2CO(g);ΔH=-221.0 kJ·mol-1
②2H2(g)+O2(g)====2H2O(g);ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+ H2O (g)====CO(g)+H2(g);ΔH为
| A.262.6 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.+131.3 kJ·mol-1 | D.-352.3 kJ·mol-1 |
密闭容器中进行如下反应: X2(气) + Y2(气)  2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度有可能是
| A.Y2为 0.35 mol/L | B.Y2为 0.2 mol/L |
| C.X2为 0.2 mol/L | D.Z 为 0.4 mol/L |
在一定温度下,可逆反应2SO2+O2 2SO3达到平衡状态的标志是
2SO3达到平衡状态的标志是
| A.容器中SO2、O2、SO3的分子数之比为2﹕1﹕2 |
| B.单位时间内生成nmol SO3,同时消耗n/2mol O2 |
| C.容器内的压强不随时间而变化 |
| D.生成SO3和生成O2的速率相同 |