室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是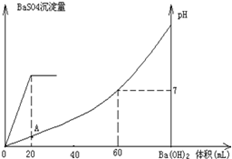
| A.图中A点溶液的pH=1 |
| B.生成沉淀的最大质量为2.33g |
| C.原混合溶液中盐酸物质的量浓度为0.1mol/L |
D.当 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO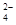 ═BaSO4↓ ═BaSO4↓ |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
H2O/ mol |
| 0 |
1.2 |
0.6 |
| t1 |
0.8 |
|
| t2 |
0.2 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.4/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.6 molCO和1.2 molH2O,到达平衡时,c(CO2)=0.2 mol·L-1。
C.保持其他条件不变,向平衡体系中再通入0.6 mol H2O,与原平衡相比,达到新平衡时H2的体积分数增大
D.温度降至550℃,上述反应平衡常数为1.26,则正反应为吸热反应
对于密闭容器中的反应:2SO2(g)+O2(g) 2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是
2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是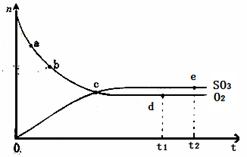
| A.点c处反应达到平衡 |
| B.点a的正反应速率比点b的大 |
| C.点d (t1时刻)和点e (t2时刻)处n(SO2)不一样 |
| D.其他条件不变,600℃时反应至t1时刻,n(SO 3)比上图中的d点值要大 |
已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l)△H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g)△H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g)△H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g)△H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 | B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 | D.0.5a>b |
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)  N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 |
I1 |
I2 |
I3 |
I4 |
| X |
500 |
4600 |
6900 |
9500 |
| Y |
580 |
1800 |
2700 |
11600 |
A.元素X与氯形成化合物时,化学式可能是XCl
B.元素Y是ⅢA族元素
C.若元素X、Y处于第三周期,X最高价氧化物对应水化物的碱性强于Y最高价氧化物对应水化物的碱性
D.若元素Y处于第三周期,它可与冷水剧烈反应