下述实验不能达到预期实验目的的是
| 序号 |
实验内容 |
实验目的 |
| A |
室温下,使用pH计测定浓度均为0.1mol/L NaClO溶液CH3COONa |
比较HClO和CH3COOH的酸性强弱 |
| B |
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 |
检验蔗糖水解产物具有还原性 |
| C |
向新生成的AgCl悬浊液中滴入KI溶液 |
研究沉淀的转化 |
| D |
室温下,向两支装有同体积同浓度过氧化氢溶液的试管中,分别加入3滴同浓度的氯化铜、氯化铁溶液 |
研究催化剂对反应速率的影响 |
通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示: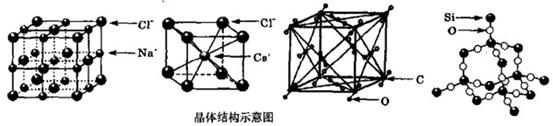
下列关于这些晶体结构和性质的叙述不正确的是
A.在氯化钠晶体中每个Cl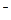 周围同时吸引6个Na 周围同时吸引6个Na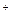 ,在氯化铯晶体中每个Cl ,在氯化铯晶体中每个Cl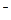 周围同时吸引8个Cs 周围同时吸引8个Cs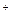 |
| B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质 |
| C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 |
| D.在二氧化硅晶体中,平均每个Si原子形成4个Si一O共价单键 |
下列文字表述与反应方程式对应且正确的是()
| A.溴乙烷中滴入硝酸银溶液检验其中的溴元素:Br-+ Ag+ =AgBr↓ |
| B.在碘化亚铁溶液中通人少量的氯气:2Fe2++Cl2= 2Fe3+ + 2Cl- |
C.实验室用液溴和苯在催化剂作用下制溴苯: |
| D.用醋酸除去水垢:CaCO3 + 2H+= Ca2+ + H2O + CO2↑ |
在下列各溶液中,离子一定能大量共存的是()
| A.强酸性溶液中:Na+、、Mg3+、Cl-、AlO2- |
| B.含有0.5 mol·L-1 Al3+的溶液中:K+、Cl-、CO32-、NO-3 |
| C.含有0.5 mol·L-1 Ca2+的溶液中:Na+、K+、HCO3-、Cl- |
| D.室温下,pH=13的溶液中:Na+、K3+、NO-3、HCO3- |
下列叙述不正确的是()
| A.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| B.锌表面镀铜,锌作阳极 |
C.工业上电解饱和食盐水的阳极反应: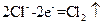 |
D.氢氧燃料电池(碱性)的正极反应是: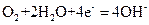 |
设NA为阿佛加德罗常数,下列叙述错误的是()
| A.46g二氧化氮与四氧化二氮的混合气体中的原子数大于3NA |
| B.28g乙烯、丙烯、丙烷的混合气体中的碳原子数小于2NA |
| C.1mol/L 500mL氯化镁溶液中的镁离子数小于0.5NA |
| D.标准状况下,11.2L三氧化硫中所含的氧原子数大于1.5NA |